Yondelis
Mode d'action:
La trabectédine appartient à la famille des alcaloïdes végétaux. Elle provoque des adduits sur le petit sillon de l'ADN, entraînant une altération de la fixation des facteurs de transcription d'un certain nombre de gènes indispensables à la division cellulaire et à la réparation de l'ADN.
Posologie:
Neutropénie < 500/mm3 pendant plus de 5 jours ou associée à une fièvre
Thrombopénie < 25.000/mm3
Augmentation du taux de bilirubine au delà de la LSN et/ou du taux des phosphatases alcalines à plus de 2,5 fois la LSN
Augmentation des transaminases (ASAT ou ALAT) à plus de 2,5 fois la LSN (en cas de monothérapie) ou > 5 x LSN (en cas de thérapie combinée), non corrigée le jour 21
Toute autre réaction indésirable cotée 3 ou 4
DCI:
Trabectedine
Voie de signalisation ciblée:
Transcription de l'ADN
Classe thérapeutique:
Autres alcaloïdes végétaux
Temps de traitement:
RCP:
[DOC] Yondelis 0,25 mg EMA 2021-08-18
Mode de prise:
Voie intraveineuse, toutes les trois semaines (24 heures en continu pour les sarcomes, 3 heures pour les cancers de l'ovaire). Tous les patients doivent recevoir des corticostéroïdes par voie intraveineuse (ex. 20 mg de dexaméthasone) 30 minutes avant l’administration du protocole de chimiothérapie (antiémétique et hépatoprotecteur).
Gélule:
Indications:
Sarcome des tissus mous évolué
Cancer de l'ovaire récidivant et sensible au platine
Effets indésirables les plus fréquents:
Principaux Effets Indésirables:
Liste exhaustive des effets indésirablesAnomalies biologiques et métaboliques
- - Créatine PhosphoKinase plasmatiques augmentées
- - Cytolyse hépatique
- - Elévation des transaminases
- - Fatigue
- - Gamma-glutamyltransférase augmentée
- - Hyperbilirubinémie
- - Hypoalbuminémie
- - Hypokaliémie
- - Hypomagnésémie
- - Neutropénie
Cancers secondaires
Hématotoxicité
- - Anémie
- - Elevation de la créatinine sérique
- - Leucopénie
- - Neutropénie fébrile
- - Thrombopénie
Rhumatologie
- - Arthralgie
- - Douleurs dorsales
- - Myalgies
Toxicités cardiaques et vasculaires
Toxicités cutanées et muqueuses
- - Agent vésicant
- - Alopécie
- - Eruption cutanée
- - Hyperpigmentation cutanée
- - Syndrome mains-pieds (érythrodysesthésies palmo-plantaires)
Toxicités digestives
- - Baisse d'appétit
- - Constipation
- - Diarrhées
- - Dyspepsie
- - Nausée / vomissement
Toxicités générales
- - Asthénie
- - Bouffées vaso-motrices
- - Céphalées
- - Déshydratation
- - Fièvre / Frisson
- - Perte de poids
- - Réaction d'hypersensibilité aiguë
- - Réaction / douleur au point d'injection
- - Septicémie
- - Toux
- - Vertiges
Toxicités neurologiques
Toxicités ORL
Toxicités pulmonaires
- - Dyspnée
- - Embolie pulmonaire
OTHER / UNDEFINED
Interactions médicamenteuses :
Inhibiteurs et inducteurs du CYP3A4 (kétoconazole oral, fluconazole, ritonavir, clarithromycine, aprépitant ou rifampicine, phenorbarbital, millepertuis) Inhibiteurs de la P-gp (vérapamil, ciclosporine) La consommation d’alcool doit être évitée (hépatotoxicité)
Mesures associées au traitement :
Conseils de prise du traitement Voie Intraveineuse en association avec la DLP (cancer de l’ovaire uniquement) : 30 minutes avant l’administration de DLP : corticostéroïdes par voie intraveineuse Perfusion de DLP : Afin de minimiser le risque de réactions à la perfusion de DLP, la dose initiale est administrée à une vitesse ne dépassant pas 1 mg/minute. Si aucune réaction indésirable à la perfusion n’est observée, la perfusion de DLP peut être poursuivie sur une durée de 1 heure Perfusion de Trabectédine : La perfusion intraveineuse de trabectédine est administrée sur une durée de 3 heures immédiatement après l’administration d’une dose de 30 mg/m2 de DLP. Interactions médicamenteuses Association avec des inducteurs ou des inhibiteurs du CYP3A4 La trabectédine étant essentiellement métabolisée par l’iso-enzyme CYP3A4, la co-administration de trabectédine et d'inducteurs ou inhibiteurs puissants de CPY3A4 (par exemple, le kétoconazole oral, le fluconazole, le ritonavir, la clarithromycine, l'aprépitant pour les inhibiteurs et le phenorbarbital, le millepertuis ou la rifampicine pour les inducteurs) doit être évitées si possible Consommation d’alcool La consommation d’alcool doit être évitée pendant le traitement par la trabectédine en raison de l’hépatotoxicité du médicament. Association avec des inhibiteurs de la P-gp La trabectédine est un substrat de la P-gp et l’administration concomitante d’inhibiteurs de la P-gp, par exemple ciclosporine et vérapamil, risque de perturber la distribution de la trabectédine et/ou son élimination. Prémédications : Prévention antiémétique Corticoïdes : Tous les patients doivent recevoir des corticostéroïdes par voie intraveineuse (ex. 20 mg de dexaméthasone) 30 minutes avant l’administration de DLP (en cas de thérapie combinée) ou de Yondelis (en monothérapie) pour la prévention antiémétique, mais également parce que ce traitement semble avoir des effets hépatoprotecteurs. D’autres antiémétiques seront au besoin administrés.
Surveillance paraclinique :
Examens à effectuer avant chaque cycle :
Les critères suivants doivent être remplis avant chaque utilisation de trabectédine
- Nombre absolu de neutrophiles ≥ 1 500/mm3
- Plaquettes ≥ 100 000/mm3
- Taux de bilirubine ≤ limite supérieure de la normale (LSN)
- Phosphatases alcalines ≤ 2,5 fois la LSN (envisager un dosage des iso-enzymes hépatiques 5’-nucléotidase ou de la gamma glutamyl transpeptidase (GGT), si l’augmentation peut être d’origine osseuse).
- Albumine ≥ 25 g/l.
- Alanine-aminotransférase (ALAT) et aspartate-aminotransférase (ASAT) ≤ 2,5 fois la LSN
- Clairance de la créatinine ≥ 30 ml/min (en cas de monothérapie), créatinine sérique ≤ 1,5 mg/dl (≤ 132,6 μmol/l) ou clairance de la créatinine ≥ 60 ml/min (en cas de thérapie combinée)
- Créatine-phosphokinase (CPK) ≤ 2,5 fois la LSN
- Hémoglobine ≥ 9 g/dl.
Proposition pratique en dehors d’un terrain particulier, ou d’une situation à risque ?
Les paramètres hématologiques, la bilirubine, les phosphatases alcalines, les transaminases et la CPK devront être à nouveau contrôlés une fois par semaine pendant les deux premiers cycles de traitement et au moins une fois entre les traitements lors des cycles ultérieurs.
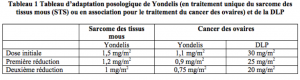
Ajustements posologiques pendant le traitement
La dose devra être réduite au niveau inférieur, pour les cycles ultérieurs si l’un des événements décrits ci-dessous survient à un moment quelconque entre les cycles :
- Neutropénie < 500/mm3 pendant plus de 5 jours ou associée à une fièvre ou une infection
- Thrombopénie < 25.000/mm3
- Augmentation du taux de bilirubine au delà de la LSN et/ou du taux des phosphatases alcalines à plus de 2,5 fois la LSN
- Augmentation des transaminases (ASAT ou ALAT) à plus de 2,5 fois la LSN (en cas de monothérapie) ou > 5 x LSN (en cas de thérapie combinée), non corrigée le jour 21
- Toute autre réaction indésirable cotée 3 ou 4 (par exemple nausées, vomissements, fatigue).
Une fois la dose réduite en raison de phénomènes toxiques, il est déconseillé de l’augmenter lors des cycles ultérieurs.
Si l’un de ces phénomènes toxiques se reproduit lors des cycles ultérieurs chez un patient qui tire un bienfait clinique du traitement, la dose peut être encore réduite.
Des facteurs de croissance hématopoïétiques peuvent être administrés en cas de toxicité hématologique selon les pratiques standards locales.